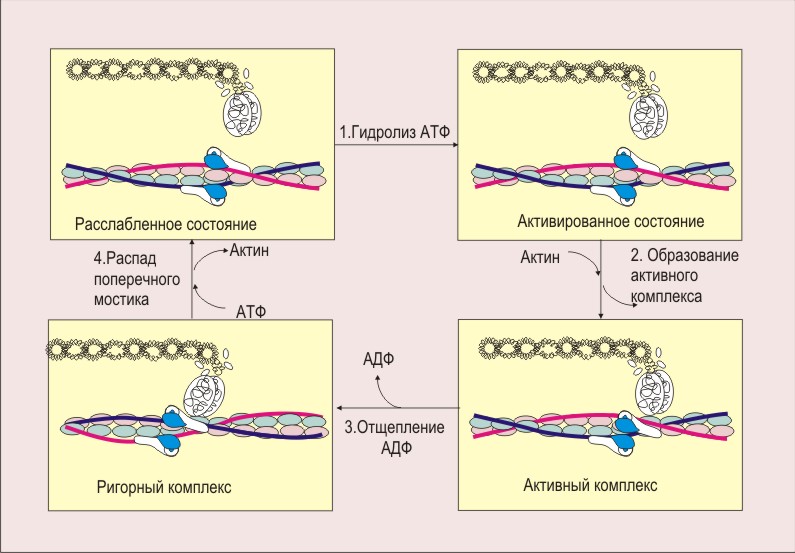
Физиологические и патологические сигналы мышечного реконструирования
Сердечная и скелетные мышцы человека и других позвоночных отвечают на изменения физиологических требований путем реконструкции архитектуры индивидуальных миоцитов , а также тканей, которым они присущи. Эти ответные реакции могут принимать несколько различных форм:
изменения общей массы ткани (гипертрофия или, напротив, атрофия);
изменения пространственных взаимоотношений миоцитов, а также других клеточных и внеклеточных компонентов мышечных тканей; и, наконец,
перепрограммирование экспрессии генов для изменения специализированных метаболических и сократительных свойств миоцитов.
При физиологических условиях реконструирование мышщы служит целям поддержания равновесия между внешними требованиями к сократительной работе и способностью мышечных тканей отвечать этим требованиям. Так, размеры сердца значительно увеличиваются в процессе нормального послеродового развития или в результате адаптации к длительным нагрузкам, отвечая, таким образом, возросшим требованиям. Глубокие преобразования скелетных мышц вызываются либо тяжелой нагрузкой (гипертрофия), либо продолжительной нагрузкой (возрастание емкости и эффективности использования кислорода).
Патологические условия также могут вызывать процессы реконструирования, первоначально напоминающие таковые при физиологической адаптации, но затем ухудшающие сократительные характеристики, приводя в конечном итоге к клиническому износу и смерти. Гипертрофия сердечной мышцы , сопряженная с увеличением сократительной способности, часто встречается на ранних стадиях заболеваний сердца, проистекающих от гипертонии или дисфункции клапана , от ишемии , приводящей к закупорке коронарной артерии; либо в результате мутаций генов, кодирующих белки саркомера . На начальной стадии данный процесс реконструирования предположительно служит целям адаптации; гиперфункционирующие миоциты устанавливают равновесие между требованиями к сократительной работе и способностью к ней. Однако при непрекращающейся патологической стимуляции сердце подвергается переходу от утолщенного, гипертрофированного состояния к тонкостенной, расширенной морфологии. Индивидуальные кардиомиоциты остаются гипертрофированными, но нормальное геометрическое распределение миоцитов нарушается, и погибающие от апопотоза или некроза миоциты удаляются фиброзной тканью. Эта последняя стадия реконструирующего ответа сопровождается функциональным ослаблением и характеризуется необратимым процессом, ведущим к смерти от коллапса кровообращения или летальной аритмии.
Миопатии скелетных мышц также характеризуются перестройкой ткани и морфологическими аномалиями, принимающими, однако, формы, отличные от таковых для сердечной мышцы, преимущественно ввиду способности к регенерации миоцитов, отсутствующей в сердце.
Хотя причины и последствия гипертрофии хорошо известны, лежащие в основе их сигнальные пути и транскрипционные медиаторы ответа менее ясны. Неизвестно также, одинаковые ли внутриклеточные пути осуществляют управление гипертрофией миоцитов сердечной и скелетной мышц, а также то, является ли физиологически благоприятная гипертрофия спортсменов зависимой от тех же механизмов, что и патологическая гипертрофия, часто ведущая к порокам сердца и внезапной смерти.
Многочисленные исследования поддержали представление о том, что активация внутриклеточных кальций - зависимых сигнальных путей представляет собою первую стадию ответа гипертрофии миоцитов, но являются ли стимулы, избирательно активирущие определенные механизмы, ведущие к конечному общему ответу гипертрофии различными, остается неясным.
Смотрите также: