Рис. 7.7 cs3 Активация протеинкиназы В при действии инсулина
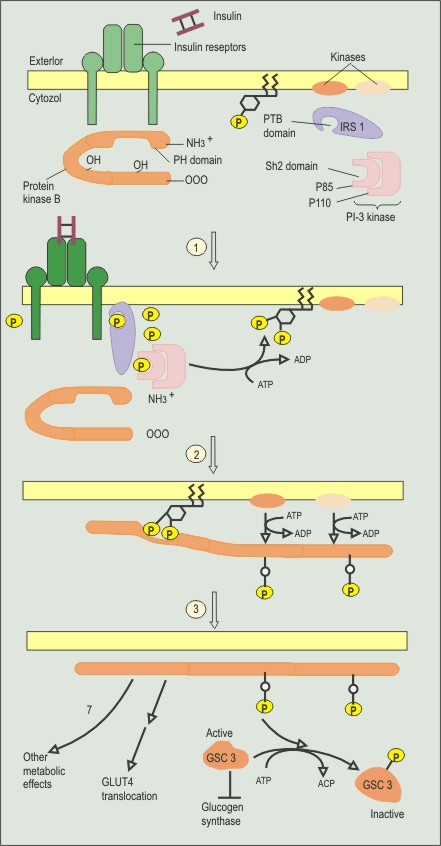
Инсулиновый рецептор является димерным тирозинкиназным рецептором.
1 - связывание инсулина с рецептором приводит к конформационным изменениям, которые вызывают автофосфорилирование. После того как IRS1 связывается с фосфотирозиновым остатком через РТВ домен, активированная киназа в цитозольном домене рецептора фосфорилирует IRS1. Одна субъединица PI-3 киназы связывается с рецептор-связанным IRS1 через свой SH2 домен, а другая субъединица затем фосфорилирует PI-4,5-P2 и PI-4-P в PI-3,4,5-P3 и PI-3,4-P2 соответственно.
2 - Фосфоинозитиды связываются с PH доменом PKB , прикрепляя ее таким образом к мембране. Две мембран-связанные киназы фосфорилируют ассоциированную с мембраной PKB и активируют ее.
3 - активированная PKB освобождается из мембраны и стимулирует потребление глюкозы, активируя транспортер GLUT и синтез гликогена . Первое происходит вследствие транслокации транспортера глюкозы GLUT из внутриклеточных везикул в плазматическую мембрану. Второе, вследствие фосфорилирования PKB гликогенсинтазы-киназы 3 ( GSK3 ), превращая ее из активной в неактивную форму. В результате GSK3-зависимое ингибирование гликогенсинтазы снимается, что приводит к стимуляции синтеза гликогена.
Ссылки на рисунок: