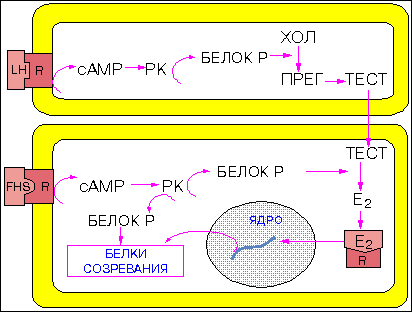
Рилизинг-факторы гипоталамические: структура и активность
Взаимосвязь структуры рилизинг-факторов с их биологической активностью наиболее полно изучена для ТРФ и ЛГ/ФСГ-РФ .
Для связывания с рецепторами и проявления биологических эффектов ТРФ необходима целостность трипептидной структуры.
По-видимому, имидазольное кольцо гистидина, находящегося во 2-м положении молекулы, играет важную роль во взаимодействии этого фактора с соответствующими рецепторами.
Аналогичную роль выполняет имидазольное кольцо гистидина и в молекуле ЛГ/ФСГ-РФ. "Адрессная" функция гистидинового остатка во 2-м положении декапептида усиливает, по-видимому, аргинин в 8-м положении его молекулы.
Актонная часть молекулы сосредоточена в основном на N-конце молекулы этого РФ и зависит от наличия Пироглу и Три (Трп) в положении 1 и 3.
Показано, что для проявления эффектов ЛГ/ФСГ-РФ, как и ТРФ, важна определенная активная конформация молекул факторов, обусловленная внутримолекулярными связями. Показано также, что C-концевой глицинамид не только не необходим для проявления биологической активности фактора, но даже тормозит ее, показывая ингибирующее влияние на гормон-рецепторное взаимодействие.
В настоящее время получены синтетические производные ЛГ/ФСГ-РФ, физиологическая активность которых может превышать активность нативного фактора на один-два порядка.
Смотрите также: