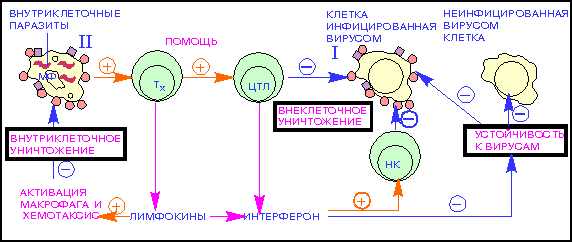
Рис. 2.4. imm_gal
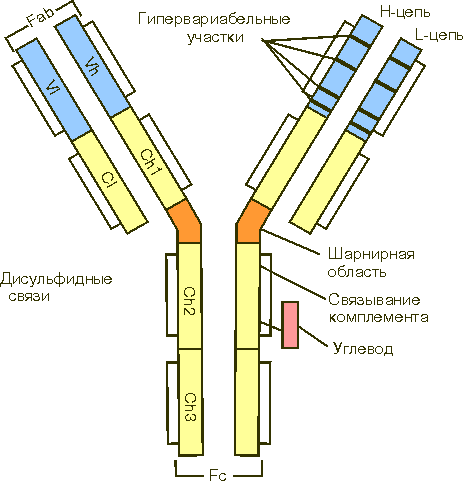
Структура IgG.
Иммуноглобулин G содержит две тяжелые (Н) цепи с мол. массой 50 кД и две легкие (L) с мол. массой 25 кД, которые объеденены в единую молекулу с помощью ковалентных дисульфидных связей -S-S-. Каждая цепь содержит вариабельную область (VL и VH для L- и H-цепей, соответственно) и константную (С) область, подразделяющуюся у Н-цепей на гомологичные участки (домены): CH1, CH2, CН3. L-цепь имеет один константный участок - CL. От взаимодействия VH- и VL-областей зависит специфичность иммуноглобулинов как антител. В аминокислотной последовательности V-доменов имеются положения, характеризующиеся частой заменой аминокислот от белка к белку (гипервариабельные участки) и более консервативные положения. Между СН1 и СН2 доменами Н-цепи находится шарнирная область, от которой зависит подвижность Fab-фрагмента. СН2-домен является местом присоединения углеводов и связывания комплемента. СН3-домен взаимодействует с Fc-рецептором на поверхности клеток, принимающих участие в иммунологических реакциях.
Ссылки на рисунок: