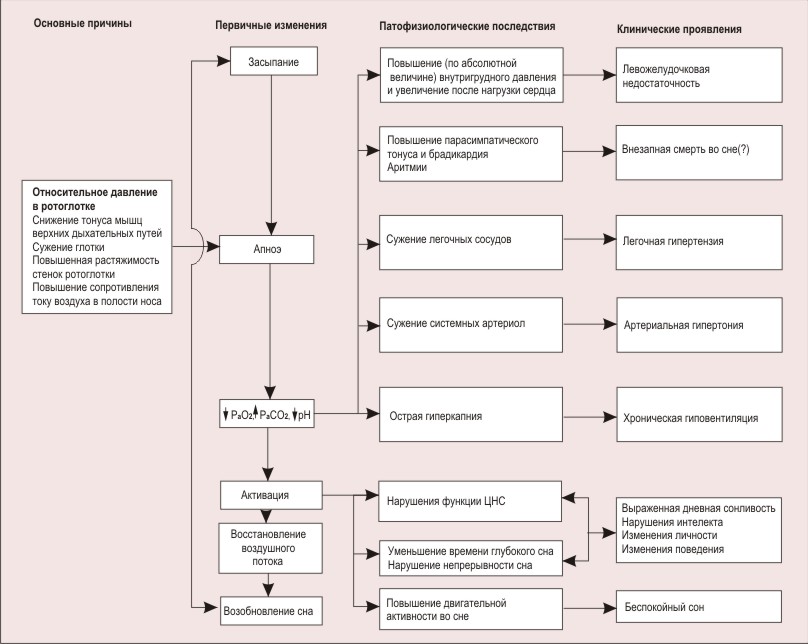
p53 белки: ацетилирование и локализация в клетке
Ацетилирование могло бы изменять активность p53 (прямо или опосредованно) влияя на его локализацию в клетке. Однако имеющиеся данные весьма туманны. Nakamura ea (2000) в своих экспериментах по трансфекции обнаружили, что изучаемые ими мутантные по лизину молекулы p53 накапливались в количествах, вдвое превышающих таковые для p53 дикого типа и локализовались в значительной степени в цитоплазме. Было очевидно, что это являлось результатом дефекта Mdm2 -зависимого обмена и распространения, но не транспорта в цитоплазму. В противоположность этому, однако, Barlev ea (2001) не выявили какой-либо предпочтительной цитоплазматической локализации мутантных молекул p53 в экспериментах по трансфекции. Несмотря на эти несоответствия, была обнаружена другая связь между ацетилированием p53 и клеточной локализацией. Pearson ea (2000) показали, что PML , белок, содержащий ДНК-связывающий домен и локализованный в ядерных тельцах (ЯТ) , индуцируется белком ras , что приводит к ко-локализации p53 и CBP в ядерных тельцах. Они обнаружили, что сверхэкспрессия PML также приводит к сопутствующему ацетилированию p53 по K320 и K382. Необходимо ли ацетилирование p53 для совместной локализации в ЯТ или его функционирования в ЯТ, остается невыясненным.
Смотрите также: