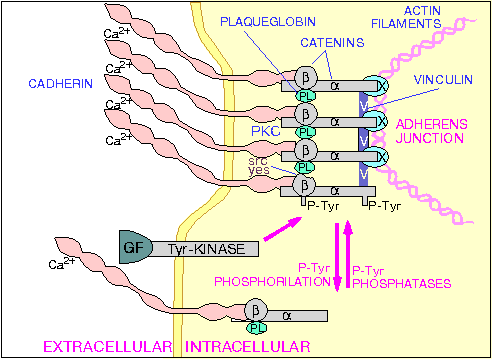
FAK и паксилин
Эти белки становятся гиперфосфорилированными в src- трансформированных клетках. Однозначно объяснить этот факт пока трудно, так как активация интегринов приводит к фосфорилированию белков фокальной адгезии и усилению взаимодействия клеток с субстратом, в то время, как в src-трансформированных клетках на фоне фосфорилирования тех же белков число фокальных контактов понижено, а структура изменена.
Взаимодействие между Src и FAK достаточно сложное. FAK аутофосфорилируется под действием интегринов, в результате чего тирозин в положении 397 становится доступен для SН2-домена Src [ Cobb B.S. et al, 1994 ]. Соответственно стимулируется киназная активность Src и происходит обратное фосфорилирование FAK по четырем тирозиновым остаткам, что приводит к индукции его полноценной активности.
Другие потенциальные субстраты Src в зоне фокальных контактов могут быть также и субстратами для FAK. Этот вопрос остается открытым, так как дискриминировать субстратную специфичность двух киназ, находящихся в комплексе, трудно.
Например, паксилин , ассоциируясь с С-концевым фрагментом FAK, может взаимодействовать с Src за счет SH3-домена [ Hildebrand J. et al, 1993 ]. Имеются доказательства, что FAK не единственный фермент, способный фосфорилировать паксилин, винкулин , таллин и тензин , так как было продемонстрировано, что в дефектных по FAK клетках мышей указанные белки остаются в фосфорилированном состоянии [ Ilic D. et al, 1995 ].
Смотрите также: