Тромбин: структура и функции
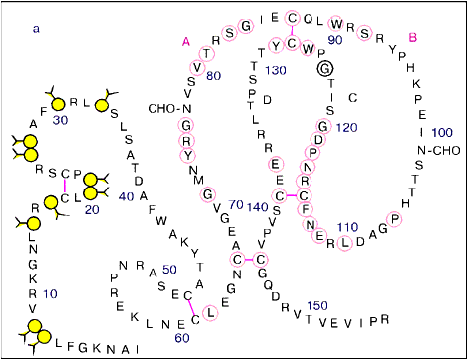
Тромбин состоит из двух полипептидных цепей: A и B (36 и 259 аминокислотных остатков соответственно), соединенных одной дисульфидной связью. Кристаллографическая структура альфа- тромбина, инактивированного D-Phe-Pro-Arg-хлорметилкетоном, определена при разрешении 1,9 А. Выявлена структурная гомология тромбина с трипсин-подобными сериновыми протеиназами , и отмечены дополнительные включения петель при Leu-60 и Thr-49, выступающие вокруг активного центра и вблизи субстрат-связывающей щели фермента.
Ряд существенных отличий определяет уникальность свойств тромбина:
1). Наличие двух анион-связывающих экзо-участков, один из которых расположен вблизи каталитического участка активного центра и ответственен за "узнавание" фибриногена . Со вторым участком связываются гепарин и другие полисахариды, а также такие отрицательно заряженные соединения, как гирудин и клеточные мембраны. Внутри этого участка и вблизи него расположены фрагменты, подверженные триптическому гидролизу и аутолизу. Альфа-тромбин превращается в бета-форму с потерей способности свертывать фибриноген, бета-тромбин превращается в гамма, эпсилон, дзета-формы.
2). Аполярный участок связывания, расположеннный вблизи каталитического активного центра тромбина. Его наличие определяет преимущественное расщепление тромбином субстратов, содержащих аргининовые и лизиновые пептидные связи, непосредственно соединенные с остатком пролина или с другими аполярными остатками.
3). Над каталитическим участком активного центра располагается фрагмент с уникальной аминокислотной последовательностью Tyr-Pro-Pro-Trp, которая обеспечивает хемотаксические свойства тромбина в отношении лейкоцитов .
4). Аминокислотная последовательность Arg-Gly-Asp обеспечивает связывание фермента с клеточными рецепторами.
Тромбин - трипсиноподобная сериновая протеиназа , характеризующаяся высокой специфичностью в отборе расщепляемых субстратов и пептидных связей, которая обусловлена наличием в молекуле наряду с классическим активным центром дополнительного центра связывания - узнавания субстратов и рецепторов. Субсайты этого центра узнавания - анионсвязывающий экзосайт 2, называемый участком связывания гепарина, и анионсвязывающий экзосайт 1, называемый также участком узнавания фибриногена. Последний, взаимодействуя с комплементарными участками специфических субстратов, ингибиторов и рецепторов, отвечает за высокую протеолитическую специфичность тромбина и его регуляторные функции [ Струкова ea 1989 , Stubbs, ea 1993 , Fenton, ea 1995 ]. Методами рентгеноструктурного анализа, направленного мутагенеза и химической модификации продемонстрирована роль анионсвязывающего экзосайта 1 в связывании тромбина с фибриногеном и фибрином , тромбомодулином , кофактором II гепарина , рецептором, активируемым протеиназой (PAR) , и высокоспецифическим экзогенным ингибитором гирудином , а экзосайта 2- c гепарином . Для связывания гирудина и других лигандов кроме положительно заряженных групп важны также гидрофобные участки молекулы тромбина [ Bode, ea 1997 ]. За аллостерическую регуляцию активности тромбина могут отвечать конформационные изменения молекулы при связывании тромбомодулина [ Струкова ea 1977 ], а также Na+ [ Wells, ea 1992 , Di_Cera, ea 1995 , Zhang, ea 1997 ].
Первые сведения о влиянии моновалентных катионов на кинетику гидролиза субстратов тромбином получены более 20 лет назад [ Струкова ea 1978 , Orthner, ea 1980 ]. В последнее время с помощью рентгеноструктурного анализа выявлены конформационные изменения, происходящие в молекуле тромбина при связывании иона Na, которые приводят к повышению скорости и специфичности при расщеплении фибриногена [ Zhang, ea 1997 ]. Идентифицированы два участка связывания Na+. Структурный переход молекулы тромбина при связывании Na+ вызывает аллостерическое конформационное изменение молекулы от "медленной" (свободной от Na+) формы к "быстрой" (связанной с Na+). При физиологических условиях (145 мМ NaCI) существуют обе формы [ Di Cera, ea 1998 ]. Переход от медленной формы к быстрой является ключевой стадией молекулярного узнавания субстратов. Быстрая форма тромбина связывает фибриноген с более высоким сродством и гидролизует его с более высокой скоростью, чем медленная. В то же время медленная форма тромбина более специфично активирует антикоагулянт - протеин С . Точечная замена Trp60 на Asp в молекуле тромбина вызывала снижение связывания Na+ и сдвиг в медленную форму, что приводило к повышению антикоагулянтной активности тромбина [ Guinto, ea 1997 ]. Такая модифицированная форма тромбина может найти применение в клинической практике для антикоагулянтной терапии наряду с широко используемыми производными дикумарина и другими антагонистами витамина К , снижающими скорость активации протромбина .
Таким образом, аллостерические изменения конформации молекулы тромбина могут определять его прокоагулянтные или антикоагулянтные свойства.
Смотрите также: