Трансгеноз для изучения цитокинов
[ Yamada ea 1994 , Poole, 1995 ].
Клетки иммунной системы общаются друг с другом посредством лимфокинов . Это очень сложная сеть коммуникаций с прямой и обратной связью, включающая в себя десятки молекул как лимфокинов, мигрирующих между клетками, так и клеточных рецепторов, принимающих от них информацию и передающих ее внутрь клетки.
Лимфокины представляют собой лишь подгруппу в большой семье эндогенных полипептидных медиаторов, вовлеченых во множество путей нормальной физиологии и патофизиологии, известных как Цитокины . С помощью трансгеноза получают важную информацию о самих цитокинах (нейротрофинах, нейрокинах и интерлейкинах) и об их рецепторах. Эта информация важна как с фундаментальной, так и с практической точек зрения. Многие болезни связаны с суперэкспрессиией одного или группы цитокинов .
Например, при септическом шоке и в хронических воспалительных процессах , таких как ревматоидный артрит , наблюдается повышенная экспрессия TNF , IL1 , IL6 и IL8 *. Они рассматриваются в качестве мишеней для терапевтического воздействия. Поэтому ищут соединения, которые могут модулировать активность цитокинов.
Список цитокинов очень велик, и он продолжает расти. Совершенствуются представления о клетках, продуцентах цитокинов и о клетках и молекулах, мишенях их действия.
Оказалось, в частности, что Т- хелперные клетки представляют собой негомогенную популяцию и состоят из по-крайней мере двух субпопуляций Th1 и Th2, секретирующих разные цитокины и играющие разную роль в иммунном ответе. Например, исследования с мышиными CD4 клетками показала что гамма интерферон и IL2 продуцируются Th1 клонами, тогда как IL4, IL5, IL6, IL10 и IL13 - Th2. Хотя ситуация у человека более сложна, есть данные, что подобные же субсеты клеток существуют и в этом случае. Каждый из них регулирует активность другого. Th1 цитокины вовлечены в регуляцию клеточного иммунитета, тогда как Th2 вовлечены в гуморальную иммунность. Возможно, что это понимание даст возможность строить терапевтическую обработкау на регулировании балланса этих двух субсетов.Этой проблеме посвящаются обзоры и книги, но наша задача - проще. Просто дать примеры, какая информация получается с помощью трансгеноза в этой области.
Как обычно, исследования шли по двум направлениям: изучение результатов потери функии, т.е. нокаутирование генов, и приобретения функции, т.е. создание животных, экспрессирующий тот или иной лимфокин вне обычного контроля.
Посмотрим сначала на результаты потери функции. Информация, получаемая с помощью нокаута очень важна, поскольку одним из возможных подходов к лечению различного рода воспалительных заболеваний является блокирование цитокинов. Нокаут дает представление о том, что может случиться при полной блокаде. И вот оказывается, что очень часто результаты получаются неожиданные. Они в очередной раз говорят нам, как мало мы еще знаем о взаимосвязях на уровне целого организма.
Например, нокаут такого центрального лимфокина, как IL2 , не влияет на лимфоидное развитие и пролиферацию. Это конечно не значит, что такая делеция никак вообще не сказывается на состоянии иммунной системы. Посмотрите в Таблицу 1 для дальнейшей информации.
Воспалительные процессы и клеточный иммунный ответ осуществляются с помощью каскадов взаимодействий, в которых клетки обмениваются информацией через молекулы-посредники. Мышь, нокаутированная по рецептору лимфокина IL-8 , подтверждает роль этой пары лимфокин- рецептор в воспалительных реакциях. Таким же способом обнаруживается важная роль лимфокина IL-10 в воспалительных процессах в тонком кишечнике. Фактор некроза опухолей ( TNF ) имеет множество биологических функций, в частности являясь медиатором синдрома септического шока. Мышь с нокаутированным рецептором этого фактора оказывается устойчивой к эндотоксинному шоку. Такие примеры можно перечислять далее.
Многие цитокины первоначально были идентифицированы как ростовые факторы, вовлеченные в опухолевую трансформацию клеток .
Например гранулоцит- макрофаг колоний стимулирующий фактор, ( GM-CSF ) или инсулин подобный ростовый фактор ( IGF-1 ). Однако, исследования нокаутированных мышей дает основания считать, что в первом случае основной функцией фактора является не контроль роста, тогда как второй фактор действительно промотирует рост клеток на эмбриональной и постнатальной стадиях развития. Небольшая сводка по результатам нокаута приведена в Таблице 1 .
В результате исследований, в которых важную роль сыграли нуль- мутации в генах различных нейротрофических факторов и лимфокинов, появились новые представления относительно универсальности систем передачи сигналов при взаимодействии этих факторов с их рецепторами. В частности, по-видимому, должна быть пересмотрена классическая концепция о независимости факторов и рецепторных систем в иммунной и нервной системах. Постоянно растушее число систем цитокин-рецептор проявляет значительное перекрывание функций в разных тканях и на разных стадиях развития. Это перекрывание во многом может обусловливать неопределенность результатов и маскировать эффект, ожидаемый от нокаута того или другого, представляющегося нам чрезвычайно важным, гена. Его функция может компенсироваться продуктами других генов.
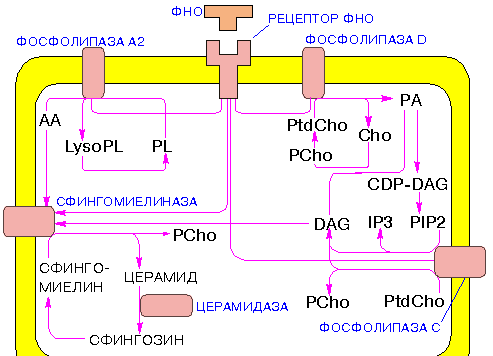
На рис 14 вы видите, как совершенно разные лимфокины действуют на один и тот же белок при передаче предписанных им сигналов в клетку. Ясно, что при таком перекрывании путей передачи возможна до некоторой степени взаимозамена. Другой пример единства элементов систем передачи сигналов дает рецептор интерлейкина-2 (IL-2). Его субъединица gc является также субъединицей у рецепторов интерлейкинов IL-4 , IL-7 , IL-9 и IL-15 .
Смотрите также: