Апоптоз: введение
Апоптоз (apoptosis, греч. apo — без, из, от и ptosis — падение, гибель, умирание, «опадание листвы») - процесс запрограммированной гибели клеток, важный для регуляции дифференцировки, гомеостаза и преобразования органов и тканей. Посредством апоптоза внутренние или внешние факторы, активируя генетическую программу, приводят к гибели клетки и ее эффективному удалению из ткани; в частности апоптоз растительных клеток, пораженных инфекционным агентом, предотвращает дальнейшее распространение инфекции. Апоптоз характеризуется активацией нелизосомных эндогенных эндонуклеаз, которые расщепляют ядерную ДНК на маленькие фрагменты. Регуляция апоптоза осуществляется с помощью разнообразных молекулярных механизмов. У эукариот существуют как ингибиторы (Bcl-2, Bcl-xL, Mcl-1, Bcl-w, аденовирусный E1B), так и активаторы (Bax, Bak, Nbk / Bik1, Bad, Bcl-xS) апоптоза. Ключевые белки апоптоза - каспазы.
Аналогом апоптоза у прокариот можно считать гибель части клеточной популяции E. coli в условиях стазиса - остановки роста бактериальной популяции (напр., при исчерпании питательного субстрата).
Генетический механизм апоптоза основан в данном случае на работе двух генов (mazE и mazF), первый из которых кодирует стабильный цитотоксический белок, а второй — белок, который является нестабильным противоядием к первому. Апоптоз отличается от других форм гибели клеток и тканей - некроза и атрофии).
Термин"апоптоз", предложенный в 1972 г. английскими учеными J.F.R. Кеrr, А.Н. Wyllie и A.R. Currie, состоит из двух греческих слов и означает в буквальном смысле "отделение лепестков от цветов", а применимо к клетке - особый тип смерти путем разделения ее на части (" апоптозные тельца "), которые впоследствии фагоцитируются соседними клетками разного типа.
Термин "программированная клеточная смерть" отражает функциональное назначение этого процесса, представляющего естественную часть жизни многоклеточного организма, связанного с метаморфозом и развитием [ Hedgecock E.M., Salston J.E. 1983 , Oppenheim R.W. 1991 ].
В генетическом аппарате многоклеточных организмов - животных, растений и грибов заложена программа гибели клеток. Это специальная программа, которая при определенных обстоятельствах может привести клетку к гибели. При нормальном развитии эта программа направлена на удаление избыточно образовавшихся клеток -"безработных", а также клеток -"пенсионеров", переставших заниматься общественно полезным трудом. Другая важная функция клеточной гибели - удаление клеток -"инвалидов" и клеток- "диссидентов" с серьезными нарушениями структуры или функции генетического аппарата. В частности, апоптоз - один из основных механизмов самопрофилактики онкологических заболеваний [ Thompson ea 1995 ].
Апоптоз играет главную роль как в развитии так и в гомеостазе [ Steller ea 1997 ]. Клетки умирают от апоптоза в развивающемся эмбрионе в ходе морфогенеза или синантогенеза и во взрослых животных в ходе обновления тканей. Система программируемой клеточной смерти - существенный фактор иммунитета , поскольку гибель зараженной клетки может предотвратить распространение инфекции по организму. Формообразовательные процессы в онтогенезе, позитивная и негативная селекция Т- и В-лимфоцитов у животных, гипер-чувствительный ответ растений на вторжение патогена, осенний листопад - лишь несколько примеров программируемой клеточной смерти (апоптоза).
Многие инфекционные агенты выработали специальные меры для предотвращения преждевременной гибели зараженных клеток. Нарушения системы программируемой гибели клетки - причина серьезной патологии. Ослабление способности к апоптозу может вести к развитию злокачественных опухолей. Некоторые заболевания, в частности дегенеративные повреждения нервной системы, - результат избыточного апоптоза.
Исследуя нормальную и патологическую ткани, J.F.R. Кеrr с соавт. [ Kerr J.F.R., Wyllie A.H. 1972 ] обнаружили, что умирающие клетки делятся на 2 категории. В сильно поврежденных тканях преобладают процессы некроза , которые затрагивают целые клеточные поля и характеризуются пассивной дегенерацией клеток с набуханием и фрагментацией органелл, разрушением мембран, лизисом клеток, выходом внутриклеточного содержимого в окружающую ткань и развитием воспалительного ответа. Некроз всегда обусловлен грубой патологией, его механизмы не требуют затрат энергии, и предотвратить его можно только, устранив причину повреждения [ Chen S. C., Soares H. D. 1996 , Chopp M., Li Y. 1996 , Sadoul R., Dubois-Dauphin M. 1996 ].
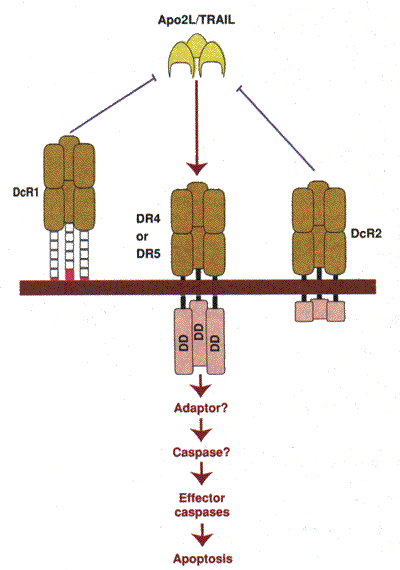
Определенные клетки организма обладают уникальными сенсорами, называемыми рецепторами смерти , расположенными на поверхности клеток. Рецепторы смерти детектируют присутствие межклеточных сигналов смерти и в ответ на это быстро запускают внутриклеточный механизм апоптоза.
Поскольку физиологическая роль апоптоза очень существенна, нарушения этого процесса могут быть весьма вредными. Так, несвоевременный апоптоз определенных мозговых нейронов оказывает влияние на образование нарушений, таких как болезни Альтцгеймера и Паркинсона , в то время как неспособность делящихся клеток перейти к апоптозу после случившихся существенных нарушений ДНК способствует развитию рака.
В развитии апоптоза выделяют 3 стадии: сигнальную (индукторную), эффекторную и деградации (деструкции). Индукторами апоптоза могут быть как внешние (внеклеточные) факторы, так и внутриклеточные сигналы. Сигнал воспринимается рецептором и далее последовательно передается молекулам-посредникам (мессенджерам) различного порядка и достигает ядра, где происходит включение программы клеточного "самоубийства" путем активации летальных и/или репрессии антилетальных генов. В ядре регистрируются первые морфологические признаки апоптоза - конденсация хроматина с формированием его осмиофильных скоплений, прилежащих к ядерной мембране. Позже появляются инвагинации (вдавления) ядерной мембраны, и происходит фрагментация ядра. В основе деградации хроматина лежит ферментативное расщепление ДНК [ Arends ea 1990 , Wyllie ea 1980 ]. Сначала образуются фрагменты, включающие 700, 200-250, 50-70 тыс. пар оснований, затем - фрагменты, содержащие 30-50 тыс. пар оснований. После реализации этого этапа процесс становится необратимым. Затем наступает межнуклеосомная дезинтеграция ДНК, т.е. разрывы нитей ДНК, находящихся между нуклеосомами. При этом образуются фрагменты, кратные по величине 180-190 пар оснований, что соответствует протяженности нити ДНК в пределах одной нуклеосомы. Отделившиеся фрагменты ядра, ограниченные мембраной, называют апоптотическими тельцами. В цитоплазме происходит расширение эндоплазматического ретикулума, конденсация и сморщивание гранул. Важнейшим признаком апоптоза является снижение трансмембранного потенциала митохондрий и выход в цитоплазму различных апоптогенных факторов (цитохрома с; прокаспаз 2, 3, 9; апоптоз-индуцирующего фактора). Именно нарушению барьерной функции митохондриальных мембран отводят ключевую роль в развитии многих типов апоптоза. Клеточная мембрана утрачивает ворсинчатость и образует пузыревидные вздутия. Клетки округляются и отделяются от субстрата. На поверхности клетки экспрессируются различные молекулы, распознаваемые фагоцитами - фосфосерин, тромбоспондин, десиалированные мембранные гликоконъюгаты, в результате чего происходит поглощение тела клетки другими клетками и его деградация в окружении лизосом фагоцитарных клеток [ Ярилин ea 2005 ].
За исследования механизмов А. Нобелевскую премию за 2002 г. получили С. Бреннер, Р. Хорвитц и Дж. Салстон.
Смотрите также: