NO синтаза II: цитотоксичность и пероксинитрит
Высокой токсичностью обладает пероксинитрит , который образуется в реакции NO с супероксид-анионом :
O2-+NO=ONOO- Константа скорости этой реакции по одним данным составляет (3,7 + 1,1) 10#7 М-1/с [ Saran, ea 1990 ]. По другой оценке, выполненной методом импульсного фотолиза, константа скорости значительно выше - (6,7 + 0,9) 10#9 М-1/с-1 [ Huie, ea 1993 ]. Аналогичные цифры получены с помощью метода импульсного радиолиза -(4,3 + 0,5) 10#9 М-1/c-1 [ Ischiropoulos, ea 1992 ]. Показано, что скорость реакции при этом не зависела от ионной силы и рН в области 6,1 -10,0. Анализ поглощения и образования О2-, оксидов азота и ONOO- альвеолярными макрофагами крыс показал, что при стимуляции клеток форболмиристатацетатом повышается как поглощение О2, так и продукция
O2-, NO2-, NO3-, ONOO-. Однако синтез оксидов азота наблюдали даже в отсутствие стимуляторов [ Ischiropoulos, ea 1992 ]. Это позволяет предположить, что синтез NO необходим для создания микробицидного потенциала легких . Среднее время жизни пероксинитрита в фосфатном буфере при рН 7,4 и 37* составляет 1-2 с, поэтому он может мигрировать в тканях. Пероксинитрит - сильный окислитель, способный окислять NH- и SH-группы белков [ Radi, ea 1991 ], что приводит, в частности, к инактивации a1-ингибитора протеиназ [ Moreno, ea 1992 ], тканевого ингибитора металлопротеиназ-1 [ Frears, ea 1996 ], Mn-СОД и Fe-СОД [ Ischiropoulos, ea 1992 ].
Известно также, что в присутствии пероксинитрита или продуктов его распада образуются тиильные радикалы глутатиона (GS*) , в результате чего последний из антиоксиданта превращается в прооксидант, инициирующий процессы перекисного окисления липидов ( ПОЛ ) [ Karoui, ea 1996 ]. ONOO~ способен индуцировать процессы ПОЛ в мембранах [ Radi, ea 1991 ] и липопротеинах [ Leeuwenburgh, ea 1997 ], вызывать однонитевые разрывы [ Salgo, ea 1995 ] и резко повышать образование 8-гидроксидезоксигуанозина в ДНК [ Inoue, ea 1995 ], гидроксилировать и нитровать ароматические кольца (в частности, тирозин и триптофан ) [ Alvarez, ea 1996 , Van der Vliet ea 1995 ], ингибировать митохондриальное дыхание (как прямо [ Szabo, ea 1996 ], так и опосредованно [ Szabo, ea 1996 ]).
В концентрациях 25-200 мкМ ONOO- вызывает переход ксантиндегидрогеназы в оксидазную форму в печени кролика [ Sakuma, ea 1997 ]. В концентрации 250 мкМ ONOO~ вызывает 50%-ную гибель бактерий E.coli [ Zhu, ea 1992 ], а в концентрациях 1-100 мМ ONOO- индуцирует гибель опухолевых клеток линий HL-60 и U-937 (но не нормальных моноцитов и эндотелиоцитов). Причем установлено, что гибель клеток осуществляется в результате классического апоптоза : с деградацией и фрагментацией ДНК, конденсацией хроматина и фрагментацией ядра [ Lin, ea 1997 ]. Апоптозная гибель клеток PC 12, в которых репрессирована Cu,Mn-СОД , также опосредована образованием больших количеств ONOO~ [ Troy, ea 1996 ]. Действие ONOO- на клетки HL-60 сопровождалось усилением продукции О2 и Н2О2 , которые могут быть вовлечены в цитотоксическое действие [ Lin, ea 1997 ]. Пероксинитрит выполняет и физиологические функции: например, ингибирует и обращает агрегацию тромбоцитов , причем не за счет конверсии в NO, а скорее через нитрование белков, которые в результате приобретают антиагрегационные свойства [ Yin, ea 1995 ]. Существенный вклад в цитотоксическое действие пероксинитрита вносит ОН-радикал , образующийся из него в результате нефентоновской реакции при понижении рН [ Beckman, ea 1990 ]. Так как данная реакция не требует участия металлов переменной валентности, содержание которых в клетках в свободном виде мало, а кроме того скорость взаимодействия О2- с NO. выше, чем с СОД, то некоторые исследователи считают, что это одна из основных клеточных реакций, приводящих к образованию гидроксильного радикала [ Freeman, ea 1994 ]:
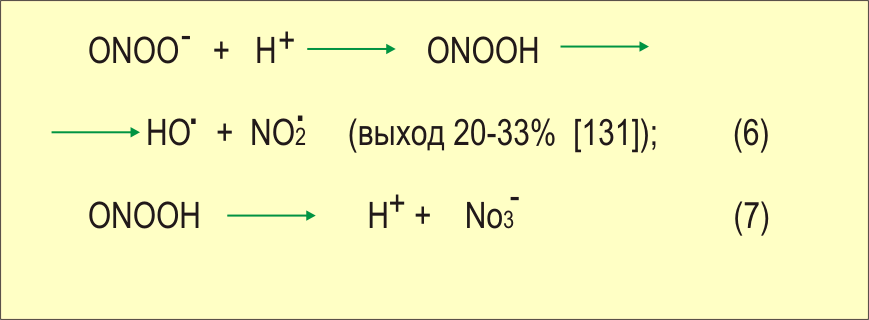
[ Freeman, ea 1994 ]
Предполагается, что образование 3-нитротирозина и дитирозина в результате реакции тирозина (или его остатков в белках) с ONOO- происходит под действием радикала NO2. , который образуется в результате распада ONOOH [ Kanner, ea 1992 ].
Ссылки на рисунок: