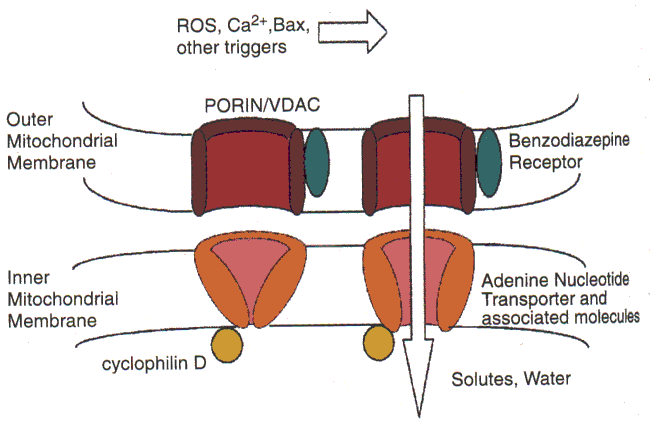
Белки индукторы и репрессоры апоптоза
В 90-х г. открыты белки как способствующие, так и препятствующие развитию апоптоза. Эти белки как бы напоминают штат нескольких инстанций судебных коллегий, которые могут либо одобрить смертный приговор, либо его отменить или приостановить исполнение. Хотя мы не знаем, в чем конкретно заключается процесс принятия решения, известно, что характер этого решения часто зависит от относительной концентрации определенных белков-регуляторов. Некоторые из этих белков - "ястребы" - обычно "голосуют" за смертный приговор, другие - "голуби" - за помилование. В ряде случаев решение принимается простым большинством голосов. Есть такой белок Bax , молекулы которого имеют сродство друг к другу и образуют димеры. Повышенное содержание белка Bax способствует развитию апоптоза. Другой белок Bcl-2 также умеет формировать димеры, но он может также присоединиться и к белку Bax, образуя при этом Bax/Bcl-2 гетеродимеры. В результате происходит нейтрализация апоптозной активности белка Bax. Таким образом, при прочих равных условиях преобладание белка Bax будет способствовать гибели клетки (при наличии соответствующего сигнала), а при преобладании белка Bcl-2, наоборот, клетка с большей вероятностью будет защищена от гибели.
Большой интерес вызывают исследования, направленные на поиск гомологов ced-генов нематоды у млекопитающих. Такими гомологами гена-убийцы ced-З (и его белковых продуктов) являются гены, кодирующие ИЛ-1бета-превращающие ферменты - каспазы (цистеиновые аспартил-протеазы), которые обладают различной субстратной и ингибирующей специфичностью. Роль каспаз в механизме апоптоза подтверждена рядом экспериментальных исследований [ Davies A.M. 1995 , Schwartz L.M., Osborne B.A. 1993 ].
Связь процессов апоптоза с основным триггером воспалительных реакций - ИЛ-1бета чрезвычайна важна и свидетельствует о единой индукции отдаленных последствий ишемии, а также о том, что программированная смерть клеток находится в тесной зависимости от локальной воспалительной реакции в ишемизированной области мозга и процессов некроза.
В результате экспериментов был найден вирусный ингибитор каспаз - протеин вируса ветрянки ( CrmA ), предотвращающий преждевременную смерть нейронов в культуре клеток, лишенной трофического обеспечения. При острой церебральной ишемии у мышей с генетически инактивированной каспазой-1 выраженность ишемического повреждения ткани мозга и поведенческих нарушений была достоверно менее представлена, чем у контрольных животных. Эти результаты подтверждены параллельными исследованиями in vitro, показавшими, что изолированные нейроны мышей с инактивированной каспазой-1 были устойчивы к апоптозу, вызванному удалением трофических факторов. Эксперименты с инактивацией каспазы-3 позволили создать мышей с увеличенным мозгом [ Waters C. 1997 ]. Таким образом, проведенные исследования продемонстрировали активирующее влияние представителей семейства каспаз на процессы апоптоза как в период развития, так и при повреждающем действии на мозг.
Гомологами гена нематоды ced-9 , определяющего выживаемость клеток нематоды, у млекопитающих является семейство протоонкогенов bcl-2 . Гены bcl-2 изначально были выявлены в B-клеточной лимфоме , где их нерегулируемая выработка блокировала механизмы клеточной смерти и таким образом поддерживала онкогенез. И Bcl-2 , и родственный ему протеин Bcl-x-l представлены в мозге млекопитающих. Они защищают нейроны от апоптоза при ишемическом воздействии, удалении факторов роста, влиянии нейротоксинов в условиях in vivo и in vitro. Анализ продуктов экспрессии bcl-2 генов выявил целое семейство bcl-2-родственных белков, включающее как антиапоптозные ( Bcl-2 и Bcl-x-l ), так и проапоптозные ( Bcl-x-s , Bax , Bad , Bag ) протеины [ Merry D.E., Korsmeyer S.J. 1996 ]. Протеины Вах и Bad обладают гомологичной последовательностью и формируют гетеродимеры с Bcl-2 и Bcl-x-l in vitro. Для активности, подавляющей смерть, Bcl-2 и Bcl-x-l должны сформировать димеры с протеином Вах , в то время как димеры с протеином Bad усиливают смерть. Это позволило сделать вывод о том, что Bcl-2 и родственные молекулы являются ключевыми детерминантами клеточного выживания или клеточной смерти в центральной нервной системе .
Определенные протеины, такие как Р53 , Р21 (WAF1), могут способствовать развитию апоптоза [ Chopp M., Li Y. 1996 , Stabberod P., Tomasevic G. 1994 ]. Было показано, что природный Р53 вызывает апоптоз в опухолевых клеточных линиях [ Yonish-Rouach E., Resnitzky D. 1991 ] и in vivo [ Schimke R.T., Mihich E. 1994 ]. Трансформация Р53 из природного типа в мутантную форму приводит к развитию рака во многих органах за счет подавления процессов апоптоза.
Смотрите также: