Моноаминоксидаза (МАО)
Основной источник: В.З.Горкин, А.Е.Медведев
Главные пути распада
катехоламинов - это О-метилирование под действием катехол-О-метилтрансферазы и окислительное дезаминирование под действием МАО. МАО содержится в митохондриях большинства клеток, и в том числе - в нервных окончаниях. Она в небольшой степени участвует в элиминации катехоламинов крови, но выполняет важную функцию по регулированию содержания катехоламинов в симпатических окончаниях.Моноаминоксидаза (МАО) - оксидоредуктаза, дезаминирующая моноамины. Она обнаружена во многих тканях, но в наибольших концентрациях - в печени , желудке , почках..
Описаны по крайней мере два изофермента МАО: МАО-А нервной ткани, дезаминирующая серотонин, адреналин и норадреналин, и МАО-В других (не нервных) тканей, наиболее активная в отношении 2- фенилэтиламина и бензиламина. Дофамин и тирамин метаболизируются обеими формами. Интенсивно исследуется вопрос о связи между аффективными расстройствами и повышением или понижением активности этих изоферментов. Ингибиторы МАО нашли применение при лечении гипертонии и депрессии, однако способность этих соединений вступать в опасные для организма реакции с содержащимися в пище и лекарственных препаратах симпатомиметическими аминами снижает их ценность.
О-Метоксилированные производные подвергаются дальнейшей модификации путем образования коньюгатов с глюкуроновой или серной кислотой.
Моноаминоксидаза [monoamine oxidase: амино-кислород оксидоредуктаза (дезаминирующая), (содержащая флавин), КФ 1.4.3.4] играет центральную роль в регуляции метаболизма биогенных аминов, многие из которых выполняют нейромедиаторные функции в живых организмах. Изучение свойств моноаминоксидазы на протяжении более 60 лет приве- ло к созданию антидепрессивных лекарственных средств - "ингибиторов моноаминоксидазы", третье поколение которых находит широкое приме- нение в медицине.
Первые сведения о существовании в ткани печени цианид- резистентного фермента, катализирующего окисление тирамина, были получены М.Хэйр в 1928 г. Классические опыты М.Хэйр получили неза- висимое подтверждение и дальнейшее развитие' помимо "тираминоксида- зы" были открыты "адреналиноксидаза", "гистаминаза", "дезаминаза алифатических аминов". В 1938 г. Е. Целлер обобщил опыт изучения аминоксидаз и сформулировал понятие о "моноаминоксидазе" (катали- зирует окислительное дезаминирование тирамина, адреналина, алифати- ческих моноаминов) и "диаминоксидазе" (катализирует окислительное дезаминирование гистамина и алифатических диаминов).
В начале 50-х годов Е.Целлер открывает специфические ингибиторы моноаминоксидазы, а в начале 60-х годов В.З.Горкин и независимо от него И.Кнолл обращают внимание на то, что некоторые ингибиторы мо- ноаминоксидазы обладают свойством избирательно блокировать окисли- тельное дезаминирование определенных моноаминов. В 1968 г. Т.Джон- стон сформулировал представление о двух типах моноаминоксидаз, различающихся по чувствительности к действию низких (порядка 0,1 мкМ) концентраций хлоргилина. К типу А относят моноаминоксидазы, блокируемые низкими концентрациями хлоргилина. Резистентные к инги- бирующему действию низких концентраций хлоргилина моноаминоксидазы относят к типу Б. Несколько лет спустя И.Кнолл синтезировал селек- тивный ингибитор моноаминоксидазы типа Б, депренил. В это же время были описаны различия в субстратной специфичности обоих типов моно- аминоксидаз.
Фармакологическая классификация моноаминоксидаз на типы A и Б породила множество идей и гипотез о природе ферментов' представляют ли часто присутствующие в одном и том же органе моноаминоксидазы А и Б два разных белка или же различия в субстратной специфичности и ингибиторной селективности обусловлены наличием двух активных цен- тров на одной белковой молекуле и/или различными компонентами (фос- фо)липидного окружения одного фермента?
В середине 70-х годов В.З.Горкин и его коллеги обнаружили, что частичное окисление сульфгидрильных групп моноаминоксидазы типа А (но не Б) сопровождается изменением субстратной специфичности ("трансформацией" каталитических свойств) и появлением качественно новых реакций дезаминирования азотсодержащих соединений, которые обычно являются субстратами диаминоксидаз, и даже азотсодержащих соединений, вообще не принадлежащих к числу субстратов аминоксидаз (глюкозамин, гамма-аминомасляная кислота и др.).
В 80-е годы были получены моноклональные антитела для моноами- ноксидаз типа А и Б, высокоспецифичные для каждого типа фермента. Пептидные карты, полученные из продуктов протеиназного расщепления очищенных моноаминоксидаз типа А и Б, свидетельствовали о различной аминокислотной последовательности ферментов.
К началу 90-х годов удалось получить кДНК, соответствующие мо- ноаминоксидазам типа А и Б из печени человека, на основании которых была установлена первичная структура этих различных белков. Было показано, что биосинтез моноаминоксидаз типов А и Б кодируется близкими, но не тождественными генами, имеющими различную промотор- ную организацию. У человека эти гены локализованы на Х-хромосоме.
Моноаминоксидаза - интегральный белок внешней мембраны митохон дрий - катализирует реакцию окислительного дезаминирования'
R-СH -NH + O + H O L R-CHO + NH + H O где R - ароматические или алифатические радикалы. Вторичные и тре- тичные амины, содержащие в качестве заместителей метильные группы, также являются субстратами моноаминоксидазы. Оптимум рН 7,0-7,4. Кинетический механизм может быть описан двумя полуреакциями. Внача- ле окисление амина ведет к образованию альдегида, NH и восстанов- ленной формы фермента'
E + R-CH -NH + H O L EH + R-CHO + NH В этой парциальной реакции в качестве промежуточного продукта обра- зуется имин, который затем реагирует с водой с образованием аммиака и альдегида'
R-CH -NH L R-CH=NH + (2H)
R-СH=NH + H O L RCHO + NH Восстановленный фермент затем окисляется с образованием перекиси водорода'
EH + O L E + H O Эта полуреакция является скорость-лимитирующей.
Кинетические исследования, проведенные главным образом на моно- аминоксидазах типа Б, показали, что в опытах с фенилэтиламином в качестве субстрата реакция протекает по механизму "пинг-понг", при этом кислород реагирует со свободной восстановленной формой фермен- та. Если же субстратом является бензиламин, то происходит образова- ние тройного комплекса восстановленный фермент - продукт реакции (аммиак) - кислород.
Молекулы моноаминоксидаз как типа А, так и типа Б представляют собой димеры, построенные из двух идентичных суб`единиц, число ами- нокислотных остатков и молек. масса которых имеют незначительные видовые различия. Суб`единица моноаминоксидазы типа А из печени че- ловека и крысы состоит из 527 аминокислотных остатков и имеет мо- лек. массу 59,7 кДа. Суб`единица молекулы моноаминоксидазы типа Б печени человека или крысы состоит из 520 аминокислотных остатков и имеет молек. массу 58,8 кДа. Молек. масса суб`единицы моноаминокси- дазы типа А плаценты человека равна 65 кДа, а моноаминоксидазы типа Б из печени быка - 57 кДа.
Каждая из суб`единиц моноаминоксидазы типа А или Б, по данным Т.Сингера, содержит ковалентно связанный FAD (8-альфа-цистеи- нил-FAD), причем аминокислотная последовательность флавинсвязываю- щих участков идентична для обоих ферментов и включает пентапептид Ser-Gly-GlyCys-Tyr (рис. 1.25). Домен, содержащий остаток цистеина, с которым осуществляется ковалентная связь, расположен в области C-конца. У моноаминоксидаз типа А остаток цистеина, участвующий в образовании тиоэфирной связи, занимает положение 406, а у моноами- ноксидаз типа Б - 397. Эта область, непосредственно участвующая во взаимодействии апофермента с флавином, имеется в молекулах всех исследованных до сих пор (вне зависимости от органа, из которого выделяли очищенные ферментные препараты, и от их видовых особеннос- тей) моноаминоксидаз. В этой области гомология аминокислотных ос- татков достигает 90%, тогда как гомология последовательсти амино- кислотных остатков не только указанного домена, а всей полипептид- ной цепи для моноаминоксидаз типов А и Б одного вида составляет 70%.
В молекуле моноаминоксидаз имеется 3 домена, в пределах которых гомология последовательности аминокислотных остатков достигает 90%, один домен участвует во взаимодействии с флавиновым компонентом, другой локализован в области N-конца полипептидной цепи и включает область ADP. Этот домен был обнаружен и в молекулах других изучен- ныхфлавиновых ферментов. Исследование моноаминоксидаз типа А пока- зывает, что эта область локализована между аминокислотными остатка- ми от 15 до 45. Наконец, третий домен занимает область от 187 до 230 аминокислотных остатков.
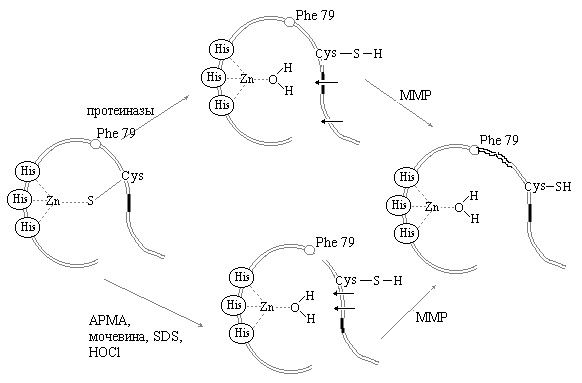
Биосинтез моноаминоксидаз осуществляется во фракции свободных (не связанных с мембранами) полисом клеток, например печени. Синте- зированные во фракции цитоплазматических полисом молекулы не под- вергаются процессингу, связанному с действием протеиназ, а транс- портируются энергозависимым путем в наружные мембраны митохондрий. По данным Р.Маккаули (рис. 1.26) для встраивания моноаминоксидаз типов А и Б в мембрану необходимо присутствие полипептида убиквити- на (UB), состоящего из 76 аминокислотных остатков, а также АТР. Для моноаминоксидазы типа Б показано, что 29 С-концевых аминокислотных остатков выполняют функцию сигнального пептида при встраивании в мембрану. Каталитически полноценная конформация мембраносвязанной формы моноаминоксидаз формируется во время связывания с мембраной, причем этот процесс предшествует АТР и UB-зависимому включению фер- мента в мембрану (см. рис. 1.26). Следует отметить, что синтез ву тщмщ моноаминоксидаз типа А и Б, оцениваемый методом количественной радиоавтографии, в периферических органах и тканях происходит быст- рее, чем в мозге; время их полужизни составляет соответственно 4,5 и 13 дней.
На функционирование моноаминоксидаз в митохондриях значительное влияние оказывают особенности мембранного микроокружения. При этом важное значение придают содержанию остатков сиаловых кислот в гли- колипидах мембран, а также состоянию и составу фосфолипидов. Обра- ботка митохондрий нейраминидазой или фосфолипазами снижает актив- ность мембраносвязанных моноаминоксидаз. Инкубация митохондрий пе- чени с липоксигеназой приводит к быстрому инактивированию моноами- ноксидаз типа Б и, в особенности, типа А при одновременном появле- нии отсутствовавшей в контроле диаминоксидазной активности. Трактуя это явление как следствие модифицирования свойств митохондриальных моноаминоксидаз, было высказано предположение, что оно может быть обусловлено изменениями фосфолипидного окружения моноаминоксидаз в мембранах.
Важное биологическое значение для функционирования моноаминок- сидаз в клетке имеют посттрансляционные модификации каталитических свойств их молекул. Так, достаточно контакта (20 час, 5 ) очищенно- го препарата моноаминоксидазы типа Б из тромбоцитов крови человека с очищенными препаратами моноаминоксидазы типа А из плаценты чело- века, чтобы индуцировать в молекулах моноаминоксидаз изменения кон- формации каталитических центров, в результате чего меняются суб- стратная специфичность и чувствительность к ингибирующему действию хлоргилина и депренила в направлении приближения их значений к ха- рактеристикам, свойственным моноаминоксидазам типа А. При этом им- мунохимическая характеристика фермента из тромбоцитов не изменя- лась.
Моноаминоксидазы широко распространены в природе. Они обнаруже- ны практически во всех органах человека и животных. Для получения препаратов моноаминоксидаз типа А обычно используют плаценту чело- века; источником препаратов моноаминоксидаз типа Б часто служат тромбоциты человека. Принято считать, что плацента и тромбоциты че- ловека содержат только один тип фермента (А или Б). При помощи 3Н-паргилина, специфически блокирующего каталитические центры моно- аминоксидаз, показано, что содержание моноаминоксидаз типа А в пла- центе человека равно 3,9 пмоль/мг, а типа Б в тромбоцитарных мем- бранах человека - 5,7 пмоль/мг белка, суммарное содержание моноами- ноксидаз обоих типов в коре и хвостатом ядре головного мозга чело- века не превышает 1,6-2 пмоль/мг белка. Иммунохимическими методами показано, что в тромбоцитах циркулирующей крови содержится 0,33 мкг моноаминоксидазы типа Б на 10 тромбоцитов, что соответствует 16500 молекул фермента на 1 тромбоцит.
Проблема физиологической регуляции моноаминоксидаз привлекает внимание исследователей, главным образом в связи с вовлечением этих ферментов в поддержание нормального функционального состояния цен- тральной нервной системы. Индуцирующий дельта-сон пептид при парен- теральном введении стимулирует активность моноаминоксидаз головного мозга крыс. Пептид головного мозга крыс нейрокатин избирательно тормозит активность моноаминоксидаз типа А. Важным регулятором ак- тивности моноаминоксидаз является трибулин (название фракции эндо- генных ингибиторов фермента, существенное увеличение которой в тка- нях и биологических жидкостях человека и животных обнаруживается при различных видах стресса); количественно преобладающий компонент этой фракции изатин (2,3-диоксоиндол) избирательно ингибирует ак- тивность моноаминоксидазы типа Б.
Биологическая функция моноаминоксидаз традиционно сводилась к защите организма от токсических воздействий экзогенных или образу- ющихся в органах и тканях биогенных аминов путем их инактивации. Моноаминоксидазы участвуют в регуляции интранейрональной концентра- ции биогенных аминов и, опосредованно, в регуляции биосинтеза мела- тонина и активности аденилатциклазы. Однако наряду с выполнением этих функций моноаминоксидазы катализируют также образование ве- ществ, обладающих собственной биологической активностью. Так, моно- аминоксидаза типа Б осуществляет окислительную биоактивацию 1-метил-4-фенил-1,2,3,6-тетрагидропиридина до нейротоксина 1-метил-4-фенилпиридиния, избирательно поражающего дофаминергичес- кие нейроны и вызывающего явления паркинсонизма у приматов и чело- века. Катализируемое моноаминоксидазами мозга деалкилирование 2-н- пентилацетамида (милацетамида) приводит к образованию пентоевой кислоты, перекиси водорода и глицинамида; последний распадается на аммиак и тормозной нейромедиатор глицин. Моноаминоксидаза входит в число основных внутриклеточных генераторов перекиси водорода и участвует в регуляции зависимого от последней выхода ионов Ca2+ из митохондрий мозга. Полагают, что моноаминоксидазы щитовидной железы обеспечивают образование перекиси водорода, необходимой для иодиро- вания молекул тирозина и, в конечном итоге, для биосинтеза иодтиро- нинов.
При патологических состояниях возможны следующие основные изме- нения свойств моноаминоксидаз: 1) частичное или (значительно реже) полное ингибирование каталитической активности; 2) стимуляция ката- литической активности; 3) частичная солюбилизация мембраносвязанных и/или нарушение встраивания растворимых моноаминоксидаз; 4) качест- венное изменение субстратной специфичности ("трансформация" катали- тических свойств) моноаминоксидаз типа А; 5) сочетание этих явле- ний.
Для лечения ряда нейропсихических заболеваний применяют избира- тельные ингибиторы моноаминоксидаз. Ингибиторы моноаминоксидазы ти- па А - антидепрессанты - используют для лечения депрессивных со- стояний, а ингибиторы моноаминоксидазы типа Б (главным образом де- пренил) - в терапии паркинсонизма.
Смотрите также: