Гемоглобин: структура и функции, краткий обзор
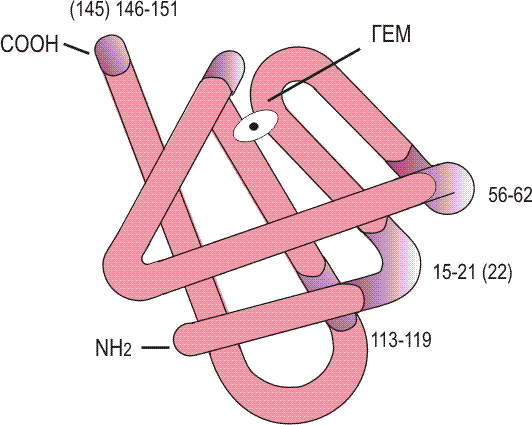
Карта белка гемоглобина позвоночных, бета-субъединица
Гемоглобин состоит из белка глобина и железосодержащего гема . Большая часть гемоглобина у взрослых состоит из двух альфа- и двух бета-цепей глобина (по 141 и 146 аминокислот соответственно). В каждую цепь глобина встроена молекула гема; содержащийся в ней атом железа связывает кислород . Переносить кислород может только двухвалентное железо.
Каждая молекула гемоглобина содержит две цепи альфа-глобина и две бета-глобина , которые кодируются генами альфа-глобиновых кластеров и генами бета-глобиновых кластеров, находящихся у млекопитающих на различных хромосомах.
Эти гены располагаются кластерами: гены, кодирующие альфа-цепи и сходные с ними дзэта-цепи, - на 16-й хромосоме , а гены, кодирующие бета-цепи и сходные с ними гамма-, дельта- и эпсилон-цепи, - на 11-й хромосоме ( рис. 107.2 ). В норме гемоглобины содержат две цепи из первой группы (альфа или дзэта) и две - из второй (бета, дельта, эпсилон или гамма).
Последовательная экспрессия различных генов глобина во время онтогенеза приводит к смене преобладающего типа гемоглобина. Так, на момент рождения преобладает синтез не бета-, а гамма-цепей, которые, соединяясь с альфа-цепями, образуют гемоглобин F (альфа2гамма2) .Нарушение нормального порядка активации генов глобина при некоторых болезнях может иметь диагностическое значение.
Гемоглобин составляет примерно 95% белков эритроцитов . Молекула гемоглобина представляет собой тетрамер, состоящий из двух гомологичных димеров. Гемоглобин нормального человека содержит 3 компонента: гемоглобин А (или А1) - Hb А, гемоглобин А2 (Hb А2), гемоглобин А3 (Hb А3). На долю гемоглобина А1 приходится 90% всего гемоглобина, в то время как гемоглобин А2 составляет 2,5%. 7,5% приходится на компонент А3, представляющий собой, по-видимому, гемоглобин А, который изменился вследствие старения красных кровяных телец.
Конформация как отдельных цепей, так и молекулы в целом может меняться, приводя к образованию форм гемоглобина с различным сродством к кислороду. Сродство гемоглобина к кислороду растет по мере присоединения кислорода к гемам молекулы, что придает кривой диссоциации оксигемоглобина характерную S-образную форму ( рис. 107.1 ). Положение этой кривой зависит от рН, РСО2 , концентраций 2,3-ДФГ и АТФ , температуры, а также дефектов цепей глобина.
Встречаются также гомотетрамеры бета-цепей - гемоглобин H и сходных с ними гамма-цепей - гемоглобин Bart . В значительных количествах они образуются лишь при дефиците альфа-цепей ( альфа-талассемии ), и их выявление важно для диагностики.
Для лечения многих заболеваний важно понимать механизм последовательной активации генов цепей глобина в соответствующие моменты онтогенеза, однако наши познания в этой области явно недостаточны. Известно, что в активном синтезе глобина во время образования эритроцитов участвует мощный энхансер , расположенный в регуляторном участке каждого гена. К активации гена приводит связывание факторов транскрипции с его промотором. Каждый ген содержит три экзона и два интрона . В процессе сплайсинга из транскрипта удаляются последовательности, соответствующие интронам. Дефекты, ведущие к талассемиям, могут возникать на любом из этапов синтеза - в процессе транскрипции, сплайсинга или трансляции.
Гемоглобин А (Hb A) содержит две альфа и две бета цепи, его формула A2B2. В гемоглобине A2 (Hb A2) вместо бета цепей находятся весьма сходные с ними дельта цепи. У взрослых людей находится также небольшое количество фетального гемоглобина (Hb F), у которого вместо бета цепей находятся гамма цепи.
Синтез гемоглобина осуществляется путем синхронного образования гема и глобиновых цепей и их сочетания с образованием полностью законченной молекулы. Активность глобиновых цепей на разных стадиях онтогенеза различна. В развитии человека можно выделить три периода, характеризующихся определенным типом эритропоэза и функционированием тех или иных гемоглобинов.
На самых ранних этапах, у двухнедельных эмбрионов эритопоэз происходит в мезенхиме желточного мешка. В этот период активно экспрессируются гены эмбриональных альфа-подобных зета цепей и бета-подобных эпсилон цепей глобинов, синтезируются также альфа и в небольшом количестве гамма цепи. Основными гемоглобинами мегалобластов являются - гемоглобин Гоуер 1 (Hb Gower I), состоящий из двух эпсилон цепей и двух зета цепей и гемоглобин Гоуер 2 (Hb Gower II), состоящий из двух эпсилон цепей и двух альфа цепей и гемоглобин Портленд.
На шестой неделе развития начинается второй период эритопоэза, протекающий в основном в печени. Зета-глобиновые цепи полностью заменяются на альфа глобиновые, начинается синтез гамма и бета цепей, а синтез эпсилон-цепей резко снижается. В течение седьмой недели развития плода уровень эпсилон-цепей падает до фонового уровня и на восьмой неделе полностью исчезает. В это время уровень бета цепей продолжает постепенно расти, достигая 10% к десятой недели развития. Значительное снижение синтеза гамма цепей и одновременное повышение синтеза бета цепей происходит за несколько недель до рождения ребенка. После рождения этот процесс продолжается и к четвертому месяцу содержание различных форм гемоглобинов у ребенка соответствует их относительному содержанию у взрослого человека.
Время жизни эритроцитов составляет около 120 дней. К концу этого периода они стареют и затем разрушаются фагоцитирующими макрофагами ретикулоэндотелиальной системы печени , ретикулоэндотелиальной системы селезенки и ретикулоэндотелиальной системы костного мозга .
Гемоглобин расщепляется на гем и глобин . Глобин распадается на составляющие его аминокислоты , которые поступают в общий фонд свободных аминокислот печени и используются в соответствии с потребностями. От гема отщепляется железо , а остающиеся пиррольные кольца образуют зеленый пигмент биливердин , который превращается в билирубин - желтый пигмент, входящий в состав желчи . Накопление билирубина в крови служит признаком заболевания печени и вызывает пожелтение кожи, называемое желтухой .
Смотрите также: